Гениальная догадка Бора
«Если тебя квантовая физика не испугала, значит ты ничего в ней не понял.»
Нильс Бор
Резерфорд создал весьма изящную модель: несмотря на то, что она многого не объясняла, все же давала общее представление о строении атома. Для разрешения всех несоответствий требовался совершенно новый взгляд на существующие проблемы и новый математический аппарат.
Итак, модель атома Резерфорда содержала многие противоречия. Для их объяснения нужно было отказаться от классических представлений, прежде всего о непрерывности энергии и момента импульса. На арену снова выходил принцип квантования физических параметров атома.
Стабилизация нестабильности
И вот в 1913 году датский ученый Нильс Бор, работавший в свое время у Резерфорда в Манчестере, предложил свое представление о строении атома. Стоит сказать, что именно Бор, работая в Кембридже, указал самому великому Томсону на ошибку в расчетах мэтра, но то ли его недостаточный английский, то ли молодость привели к тому, что работа с Томсоном у Бора так и не сложилась.

Настало время создания модели, способной согласовать теорию и эксперимент. Бор показал, что несовпадение экспериментов Резерфорда с выводом возникло потому, что поведение микрочастиц нельзя описывать теми же законами, что и макроскопических тел. Он предположил, что величины, характеризующие микромир, должны квантоваться, то есть, как мы уже знаем, могут принимать только определенные дискретные значения. К сожалению, эти законы в начале XX столетия еще не были установлены наукой.
«Нет сомнения, что перед нами безумная теория, но весь вопрос в том, достаточно ли она безумна, чтобы оказаться еще и верной!» (Нильс Бор)
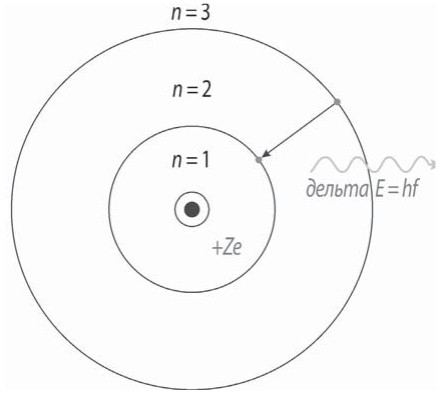
Объяснив дискретность (скачкообразность) энергетических состояний простых атомов, Бор в своей теории подошел к объяснению многих внутриатомных процессов с принципиально новых позиций, она стала первой полуквантовой теорией атома. Ее значение состоит в смелом предположении о существовании стационарных состояний и скачкообразных переходов между ними. Эти положения позднее были распространены и на другие микросистемы.
За основу Бор взял планетарную модель атома Резерфорда. Как вы помните, с точки зрения классической электродинамики электрон в модели Резерфорда, двигаясь вокруг ядра, должен был бы излучать непрерывно и очень быстро, потеряв энергию, упасть на ядро. Бор допустил, что электроны в атоме могут двигаться только по определенным орбитам, находясь на которых, они не излучают, а излучение или поглощение происходит только в момент перехода с одной орбиты на другую. Причем стационарными являются только те орбиты, при движении по которым момент количества движения электрона равен целому числу постоянных Планка.