Закон идеального газа
Давление, объем и температура газа связаны между собой, и закон идеального газа определяет, как именно. Если вы нагреваете газ, он стремится расшириться; если вы сжимаете его, он занимает меньше места, но создает более высокое давление. Закон идеального газа знаком и авиапассажирам, дрожащим от одной мысли о том, какой жуткий холод стоит за бортом, и альпинистам, знающим, что по мере восхождения к вершине температура воздуха и давление будут падать. Даже Чарлз Дарвин смог обвинить закон идеального газа в том, что, когда он находился в лагере, разбитом высоко в Андах, там никак не удавалось сварить картошку.
Если вы когда-нибудь пользовались скороваркой, значит, пользовались и законом идеального газа. Ведь что такое скороварка? Кастрюля с крышкой, пригнанной так плотно, что во время приготовления еды пар не может выйти из нее наружу. Поскольку пар, образовавшийся при кипении воды, из кастрюльки не выходит, давление внутри нее повышается. И давление может возрасти настолько, что кипящая вода больше не сможет испаряться, а потому температура варева превысит обычную температуру кипения воды, 100 градусов по Цельсию. В итоге еда приготовится быстрее, а во вкусе не потеряет.
«Есть обнадеживающий символизм в том, что в вакууме флаги не развеваются» Артур Ч. Кларк, р. 1917
Закон идеального газа, впервые сформулированный в XIX веке французским физиком Эмилем Клапейроном, описывает взаимосвязь давления, температуры и объема газа. Давление возрастает и при уменьшении объема, и при росте температуры. Представьте себе коробку с воздухом. Если вы сумеете уменьшить объем коробки вдвое, давление в ней удвоится. Если нагреете коробку, удвоив ее начальную температуру, опять-таки удвоится и давление в ней. Выводя закон идеального газа, Клапейрон объединил два более ранних закона — один был получен Робертом Бойлем, другой Жаком Шарлем и Жозефом Луи Гей-Люссаком. Бойль обнаружил связь между давлением и объемом, а Шарль и Гей-Люссак — между объемом и температурой. Клапейрон соединил три этих параметра, размышляя о количестве газа, именуемом «молем», — этот термин описывает определенное число атомов или молекул, а именно 6х1023 (6 с 23 нулями), известное также как число Авогадро. Число это выглядит колоссальным, но примерно столько атомов вы найдете в графитовом стержне карандаша. Моль определяется как число атомов углерода-12 в 12 граммах углерода. Можно сказать и так: если собрать число грейпфрутов, равное числу Авогадро, они займут объем, равный объему Земли.


Идеальный газ
Но что же такое идеальный газ? Попросту говоря, это газ, который подчиняется закону идеального газа. А делает он это потому, что атомы или молекулы, из которых он состоит, очень малы в сравнении с расстояниями между ними и потому, сталкиваясь, просто отскакивают друг от дружки, не задевая соседей. Кроме того, в таком газе не существует дополнительных сил, которые могли бы заставить их слипаться, подобно частицам с разными электрическими зарядами.
«Благородные» газы, такие как неон, аргон и ксенон, ведут себя как идеальный газ, состоящий из отдельных атомов (а не молекул). Легкие симметричные молекулы — водород, азот, кислород — ведут себя почти как идеальные газы, но чем тяжелее молекулы газа — бутана, к примеру, — тем более отклоняется он в своем поведении от идеального.
Газы обладают очень низкой плотностью, их атомы или молекулы никак не соединяются друг с другом, но двигаются совершенно свободно. В идеальном газе атомы ведут себя, как резиновые шарики, выброшенные на корт для игры в сквош, — стукаются один о другой и о стенки сосуда, в котором находится газ. Собственных границ газ не имеет, но может содержаться в сосуде определенного объема. При уменьшении этого объема расстояние между частицами газа сокращается, отчего, согласно газовому закону, возрастают давление и температура.
Давление идеального газа порождается силой, с которой атомы и молекулы ударяются о стенки сосудов и друг о друга. Согласно третьему закону Ньютона, отскакивающие после столкновений частицы воздействуют на стенки с той же силой, с какой и она на них, но противоположно направленной. Столкновения со стенками упруги, то есть частицы газа отскакивают, не теряя энергию и не прилипая, однако передают сосуду импульс, который и воспринимается как давление. Импульс мог бы и сдвигать сосуд с места, однако сосуд противится перемещению, а силы ударов действуют в самых разных направлениях, в среднем уравновешивая друг друга.
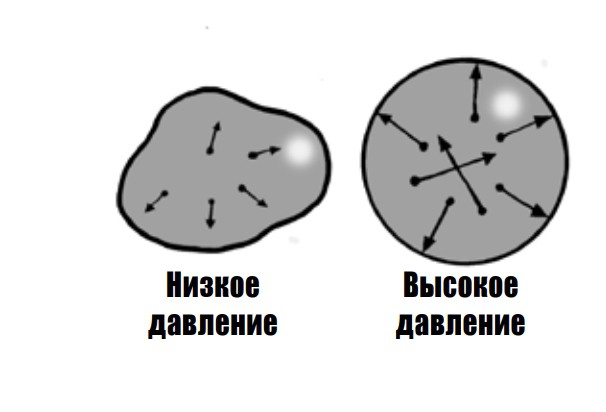
Повышение температуры увеличивает скорость частиц газа, так что давление на стенки еще усиливается. Тепловая энергия передается молекулам, увеличивая их кинетическую энергию и заставляя двигаться быстрее. Ударяясь о стенки, они передают им больший импульс, что опять-таки приводит к росту давления.
Уменьшение объема увеличивает плотность газа, отчего столкновения со стенками происходят чаще, — снова повышается давление. Повышается и температура, а закон сохранения энергии приводит к тому, что молекулы, получая меньше пространства для полетов, начинают ускоряться.
Некоторые из реальных газов не следуют этому закону в точности. Если газ состоит из больших и сложных молекул, в нем могут возникать дополнительные силы, да и слипаются такие молекулы чаще, чем в идеальном газе. Силы слипания могут возникать благодаря электрическим зарядам атомов, из которых состоят молекулы, проявление их более вероятно, когда газ сильно сжат или сильно охлажден, поскольку при таких условиях молекулы движутся медленно. По-настоящему липкие молекулы — белков или жиров — вообще никогда газов не образуют.
Давление и высота над уровнем моря
Когда вы поднимаетесь на гору, атмосферное давление падает в сравнении с давлением на уровне моря — просто потому, что слой атмосферы над вами становится тоньше. Возможно, вы замечали, что это сопровождается и падением температуры. При полете на самолете температура за его бортом падает значительно ниже точки замерзания воды. Все это — проявления закона идеального газа.
На большой высоте атмосферное давление невелико, отчего вода закипает при более низкой, чем на уровне моря, температуре. В результате продукты не провариваются, поэтому альпинисты иногда используют скороварки. Еще Чарлз Дарвин сокрушался, что во время путешествия по Андам в 1835 году у него такой при себе не было, хотя он знал о «пароварке», изобретенной французским физиком Денисом Папеном в конце XVII века. Вот что писал Дарвин в своем «Путешествии натуралиста вокруг света на корабле "Бигль”»:
В том месте, где мы ночевали, вода, как и следовало ожидать, вследствие пониженного атмосферного давления кипела при температуре более низкой, чем в местах, лежащих не так высоко, - явление, обратное тому, какое происходит в папеновом котле. По этой причине картофель, находившийся несколько часов в кипящей воде, остался почти таким же твердым. Котелок простоял на огне всю ночь, на следующее утро снова кипел, и все-таки картофель не сварился. Я узнал об этом, подслушав разговор двух моих спутников; они рассудили просто - что "проклятый котелок (а он был новый) не желает варить картофель”».
Вакуум
Если вам удастся взлететь с горы вверх, выйти за пределы атмосферы — быть может, в космос, — то давление упадет почти до нуля. Совершенный вакуум не содержит никаких атомов, однако в пределах вселенной его нигде не существует. Даже в космосе найдутся редкие атомы — скажем, несколько атомов водорода на кубический сантиметр. Греческие философы Платон и Аристотель не верили в существование чистого вакуума, поскольку «ничто» не существует.
В наше время квантовая механика также отметает идею вакуума как пустого пространства, утверждая, что он кишит элементарными частицами, нарождающимися и исчезающими. Космология утверждает даже, что в космосе может существовать отрицательное давление, проявляющееся как темная энергия, которая убыстряет расширение вселенной. Похоже, природа и вправду не терпит пустоты.
