Как изменяются свойства химических элементов?
Химические свойства элементов напрямую зависят от строения атома, и именно оно обуславливает положение каждого элемента в таблице.
Почем атомный номер важнее атомной массы?
Если ты внимательно посмотришь на некоторые элементы в таблице, то обнаружишь, что кобальт (Со), атомная масса которого 58,9, стоит перед никелем (Ni), у которого атомная масса равна 58,7. То есть более тяжелый металл стоит перед более легким. Такая же ситуация с теллуром (Те, 127,6) и йодом (I, 126,9). Интересно, чем руководствовался Менделеев, располагая элементы в таком порядке? Химическими свойствами этих элементов. А вот от чего зависят эти свойства, химики того времени еще не знали. Но сейчас достоверно известно, что химические свойства элементов зависят от числа электронов в атоме и расположения электронных облаков. Именно поэтому атомный номер является более важным критерием и характерным признаком атома. Он равен числу электронов атома и числу протонов атомного ядра. Электроны, находящиеся на внешнем электронном слое, определяют способность атомов взаимодействовать с другими атомами.

МОСКОВИЙ ЖИВЕТ МЕНЕЕ СЕКУНДЫ. Этот элемент, ранее известный под временными названиями унунпентий и экависмут, отличается крайней нестабильностью и подвергается полураспаду в течение очень незначительного промежутка времени, равного приблизительного 220 миллисекундам.
Свойства в группах и периодах
Периодическая таблица систематизирует не только элементы, но и их свойства. У тебя может возникнуть логичный вопрос: «Как запомнить свойства каждого элемента, ведь их в таблице так много?» Но в этом нет необходимости. Откроем небольшой секрет: чтобы рассказать о любом элементе и его свойствах, достаточно знать, в каком месте периодической системы он находится.
Например, мы уже говорили о том, что хлор (CI) — это очень ядовитый газ, который активно реагирует с металлами. Посмотрим на его соседа сверху. Это фтор (F). Логично было бы предположить, что фтор — это тоже газ, обладающий похожими свойствами. Так и есть!
Давай разберемся, как меняются свойства элементов в группах.
В группах у всех элементов сходное электронное строение. Но различие между элементами группы заключается в том, что при перемещении по группе сверху вниз меняется размер атома: его радиус увеличивается.
Увеличение радиуса атома приводит к следующим изменениям:
- чем больше атом, тем меньше внешние электроны притягиваются к ядру атома;
- атом может отдавать больше электронов для образования металлической связи. Это означает, что в группах металлические свойства элементов усиливаются при перемещении по группе сверху вниз, а неметаллические — ослабевают.
Какие изменения происходят в периодах?
В периодах радиусы атомов уменьшаются слева направо. С уменьшением радиусов увеличивается количество электронов, и, соответственно, металлические свойства элементов ослабевают, а неметаллические — усиливаются.
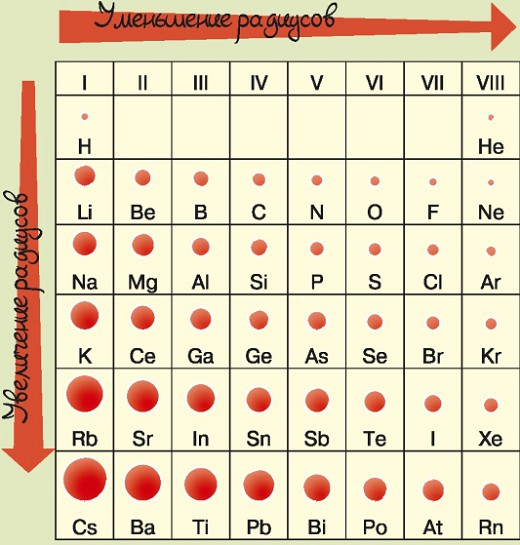
Обрати внимание: в периодах вместе с уменьшением радиуса атома увеличивается его масса.
Посмотри внимательно на эту таблицу: первый в 3-м периоде — щелочной металл натрий (Na), а последний — инертный газ аргон (Аг).
