Такое позитивное ядро
Известно, что атомы в целом электрически нейтральны, и, если вырвать из них электроны, оставшаяся часть должна быть положительно заряженной. В 1909 году Эрнест Резерфорд собрал команду, чтобы обнаружить этот положительный компонент атома, и дал миру то, что и сегодня все еще возбуждает пытливые умы ученых, — ядерную физику.
К тому времени Эрнест Резерфорд уже был лауреатом Нобелевской премии (по химии за 1908 год). Столь высокой чести он удостоился за свои работы в канадском университете Макгилла в Монреале. В 1901 году вместе со своим ассистентом Фредериком Содди он заметил, что торий при радиоактивном распаде дает газообразный продукт, который также обладает свойством радиоактивности, а химический анализ показал, что в тории накапливается радий. Эти ученые смогли понять механизм радиоактивного распада — атомы некоторых элементов являются нестабильными и постепенно превращаются в атомы других элементов, испуская в процессе распада электрически заряженные частицы.

Предложенная Томсоном модель атома «пудинг с изюмом» позволяла объяснить тот факт, что отрицательно заряженные электроны покидают атом (бета-излучение), однако она не могла объяснить альфа-излучение, когда атомы испускают положительно заряженные альфа-частицы.
Пудинговая модель атома

Дж. Томсон предположил, что электроны рассеяны в атоме, как изюм в пудинге. Они составляют лишь малую долю массы атома, а вся остальная должна приходиться на «пудинговую» его часть. При этом заряд ее должен быть равным по величине и противоположным по знаку суммарному заряду электронов. Модель атома Томсона (ее называют «модель сливового пудинга») была, по сути, первой догадкой о внутренней структуре атома. Впрочем, вскоре ее сменила другая теория.
Опровержение пудинговой модели
К 1909 году Резерфорд возвратился в Англию и обосновался в Манчестерском университете — там, где за век до этого Джон Дальтон сделал первое обоснованное предположение о существовании атомов. Для проведения эксперимента Резерфорд привлек к работе двух исследователей — Ханса Гейгера, который к тому времени уже изобрел свой счетчик радиоактивных излучений, и Эрнста Марсдена. Он планировал изучить структуру атома при помощи потока альфа-частиц, подозревая, что тот устроен сложнее, чем предположил Томсон. Концепция «пудинга с изюмом» требовала, чтобы отрицательные электроны были распределены по объему положительного «пудинга» абсолютно равномерно, и Резерфорд решил проверить этот факт облучением золотой фольги положительно заряженными альфа-частицами. Если атомы золота действительно напоминают регулярно расположенные островки пудинга, то частицы должны пройти сквозь фольгу насквозь без каких-либо существенных отклонений.
Необъяснимые отскоки
Хотя Резерфорд изначально не верил, что альфа-частицы могут отскакивать от фольги, он распорядился поместить полупрозрачный люминесцентный экран по кругу и отслеживать особенно внимательно, что ничего не отскакивает обратно. Неожиданно эта новая установка показала, что малая доля альфа-частиц все же отскакивает от фольги почти в противоположном направлении. Как сообщают, Резерфорд от радости исполнил танец хака, когда узнал эту новость. Позже он писал так: «Представьте себе, что 15-дюймовый снаряд отскакивает от папиросной бумаги почти назад и поражает стрелка».
Хака — ритуальный танец новозеландских маори, во время которого исполнители топают ногами, бьют себя по бедрам и груди и выкрикивают аккомпанемент. Резерфорд был выходцем из Новой Зеландии.
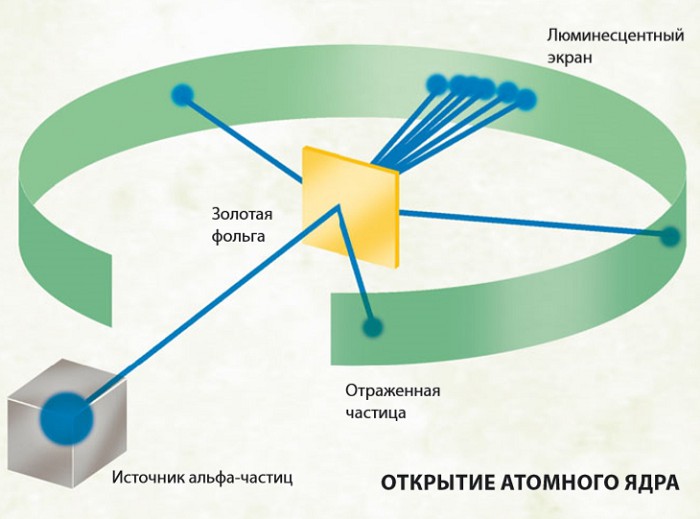
Резерфорд интерпретировал результаты эксперимента так. Альфачастица отскакивает от положительно заряженной части атома, и произойти это может только в том случае, если положительно заряженный компонент сконцентрирован в компактной центральной части, то есть ядре. Тогда электроны вращаются по своим орбитам, подобно планетам (эта модель получила название «планетарной»), удерживаемые электростатическим притяжением ядра. В таком случае атом должен состоять практически из пустоты, и именно поэтому большая часть альфа-частиц пролетела сквозь золотую фольгу, даже не отклонившись. Это планетарное представление об атоме господствует и по сей день, хотя квантовая физика уже давно доказала, что атом устроен значительно сложнее. (Квантово-механические представления появились вскоре после опубликования планетарной модели атома Резерфорда.)
