Число Авогадро
Закон Авогадро гласит, что в одинаковых объемах идеальных газов при одинаковом давлении и одинаковой температуре содержится равное число молекул. Другими словами, моль любого газа при одинаковых давлении и температуре занимает один и тот же объем. Моль — количество вещества, которое содержит столько же структурных единиц, сколько содержится в 12 г изотопа углерода 12С. Структурные единицы — это любые частицы (атомы, молекулы, электроны, ионы и т.д.). Их количество в 1 моле вещества называется числом Авогадро. Оно позволяет определить такие величины, как заряд электрона, масса атома или молекулы и др.
Как же все это понимать? Возьмем химическую реакцию, которая происходит при горении дерева. При соединении углерода древесины с кислородом воздуха образуется двуокись углерода СО2. У одного атома углерода такая же масса, как у 12 атомов водорода, а у двух атомов кислорода — как у 32 атомов водорода. Следовательно, соотношение масс участвующих в реакции углерода и кислорода всегда будет составлять 12 : 32. Соотношение остается неизменным при любых единицах измерения: 12 г углерода всегда реагируют с 32 г кислорода, 12 ц углерода — с 32 ц кислорода и т.д. В химических реакциях главное — относительное количество атомов каждого элемента, который участвует в реакции.
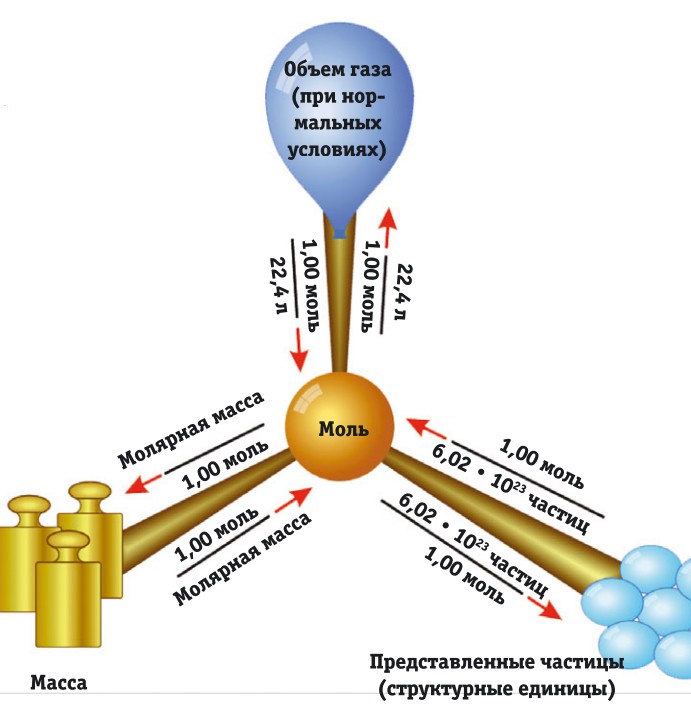
Следовательно, в 12 г углерода столько же атомов, сколько в 16 г кислорода. Именно это количество атомов химики и называют молем. Если принять относительную атомную массу вещества за n (иными словами, его атом в n раз тяжелее атома водорода), то масса одного моля этого вещества будет равна n г. Моль — мера количества вещества, как пара, десяток или сотня. Сапог в паре всегда два, яиц в десятке всегда десять, и в моле вещества всегда одно и то же количество атомов, ионов или молекул.
Но как ученые к этому пришли? Ведь сосчитать атомы очень сложно. Все началось с исследований итальянского химика Амедео Авогадро. Он знал, что, когда между газами протекает химическая реакция, соотношение между объемами газов равно соотношению между количествами их молекул. Так, когда три молекулы водорода Н2 вступают в реакцию с одной молекулой азота N., то образуется две молекулы аммиака NH3, а объем участвующего в реакции водорода оказывается в три раза больше объема азота. Авогадро пришел к выводу, что количество молекул в обоих объемах находится в соотношении 3:1, т. е. в равных объемах газа содержится равное количество атомов или молекул. Это и есть известный сегодня закон Авогадро.

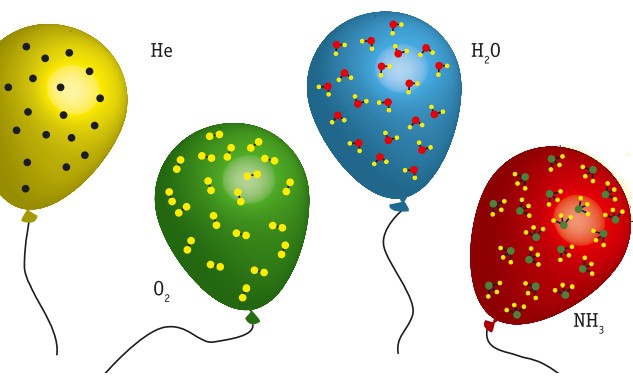
Чему равно число Авогадро?
Самому Авогадро не было известно, какое количество атомов или молекул содержится в одном моле вещества. Современная наука точно определила, что это число, или число Авогадро, NA = 6,02 • 1023.

