Молекулы и кристаллы: соединения атомов
Молекула — мельчайшая частица вещества, сохраняющая его химические свойства. Молекулы состоят из атомов. Атомам свойственна электроотрицательность, то есть способность оттягивать к себе электроны других атомов. Самая высокая степень электроотрицательности у галогенов (фтора, хлора и т.д.) и сильных окислителей (например, кислорода), самая низкая — у активных металлов.
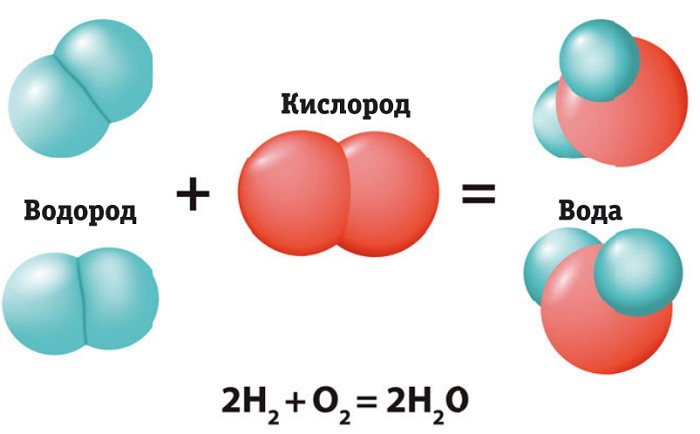
С электроотрицательностью связано понятие химической связи. Если электроотрицательности у атомов равны, то образуется ковалентная неполярная связь. У атомов возникает общая электронная пара, как в молекуле водорода Н2.
Если электроотрицательность атомов отличается не сильно, образуется ковалентная полярная связь. Обычно это бывает между атомами неметаллов, например в молекуле воды Н20 или соляной кислоты НСl.
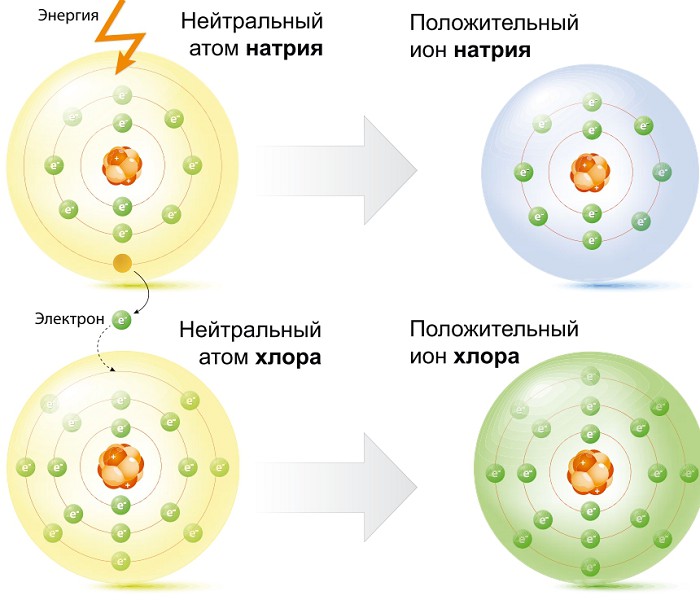
Если электроотрицательность отличается существенно, то один электрон полностью переходит к другому атому — образуются два иона. Так возникает ионная связь. Обычно это бывает между атомами металла и неметалла, например в молекуле поваренной соли NaQ.
Металлическую связь образуют свободные электроны между ионами металлов, составляющих кристаллическую решетку. В металлическом типе связи понятия молекулы нет, а есть только атомы металлов, которые постоянно переходят в ионы и наоборот, и скопление электронов в межатомном пространстве.
Между молекулами тоже возникают свои взаимодействия. Они бывают индукционными, ориентационными, дисперсионными. Особый вид связей — водородные. Они возникают между молекулами или внутри молекул, где есть сильно полярные ковалентные связи Н—О, Н—F или Н—N.
С чем же связаны электроотрицательность и способность отдавать и принимать электроны? Они связаны с электронными оболочками атомов, внешними и внутренними. В каждой оболочке имеется определенное число электронов, и если она полностью занята, то действие сил, которые простираются за ее пределы, очень слабое. Если для заполнения оболочки не хватает электронов, их расположение становится асимметричным, очень интенсивные силы проникают за пределы атома, в результате он отдает «лишние» электроны и принимает «недостающие». Так образуются молекулы.
Почему золото желтое

Цвет металлов зависит от плотности слабо связанных внешних электронов. При возбуждении молекулы электроны переходят с одного уровня на другой, что вызывает изменение в спектре (распределении энергии электромагнитного излучения по частотам или длинам волн). Электронные переходы у большинства металлов находятся в ультрафиолетовом диапазоне, а потому они бесцветны, точнее, серебристы. У золота спектр поглощения смещен в видимую область, и поэтому чистое золото обладает желтоватым оттенком.
